
近日,必贏bwin線路檢測(cè)中心研究生導(dǎo)師侯君團(tuán)隊(duì)在中國(guó)化學(xué)會(huì)主辦����、中國(guó)醫(yī)學(xué)科學(xué)院藥物研究所承辦的中科院Q1區(qū)SCI刊物Chinese Chemical Letters(IF:8.455)發(fā)表題為“Erythrocyte membrane encapsulated gambogic acid nanoparticles as a therapeutic for hepatocellular carcinoma”的研究��。
藤黃酸是一種具有多種抗腫瘤活性的中藥提取物��,但其極低的水溶性及較短的半衰期限制了其臨床使用��,在這項(xiàng)工作中���,將天然紅細(xì)胞膜與可降解聚合材料相結(jié)合構(gòu)建了一種新的負(fù)載藤黃酸的仿生納米載藥系統(tǒng),并對(duì)其進(jìn)行了一系列物理表征����,包括粒子形態(tài)的觀察,粒徑和電位的測(cè)量����,考察了仿生納米制劑在低溫保存下的穩(wěn)定性以及其在生理PH溶液和酸性緩沖溶液中的釋放度。隨后該文章考察了其體外的生物相容性及抗肝癌細(xì)胞活性����。最后,此文章進(jìn)一步探究其在荷瘤小鼠體內(nèi)的抗腫瘤活性及全身用藥安全性���。研究結(jié)果表明�����,該仿生納米制劑具有良好的物理特征和穩(wěn)定性�����,并在體外可有效延緩藥物的釋放���,對(duì)血液���、正常肝細(xì)胞及小鼠主要臟器具有可靠的安全性,展現(xiàn)出良好的抗腫瘤活性�����,值得更深入的實(shí)驗(yàn)去檢測(cè)其控釋效果����。論文通訊作者為必贏bwin線路檢測(cè)中心碩士生導(dǎo)師侯君,四川省人民醫(yī)院藥學(xué)部師健友研究員和白蘭副主任藥師為該論文共同通訊作者�����。第一作者為西南交通大學(xué)必贏bwin線路檢測(cè)中心碩士研究生劉瑞杰,共同第一作者為成都中醫(yī)藥大學(xué)藥學(xué)院碩士研究生何利�����。
肝癌是人類第四大癌癥死亡原因�,肝細(xì)胞性肝癌(hepatocellular carcinoma,HCC) 在其病例中占比較高�,是其主要亞型。現(xiàn)有抗晚期肝癌藥物的毒副作用明顯�����,服藥患者出現(xiàn)腹瀉����、皮膚病��、厭食�、脫發(fā)等多種不良反應(yīng)。因此�����,開(kāi)發(fā)新的抗晚期肝癌的藥物迫在眉睫����。 藤黃酸(gambogic acid�,GA)為藤黃中主要活性物質(zhì)之一��,早已發(fā)現(xiàn) GA有抗肝癌等移植性腫瘤活性�。經(jīng)過(guò)多年的抗腫瘤研究發(fā)現(xiàn),GA為廣譜抗癌物質(zhì)�,對(duì)肝癌、肺癌�����、胃癌�����、乳腺癌和結(jié)腸癌等均有良好的活性��,并具有良好的安全性�����。然而��,GA水中的溶解度低����,半衰期短���,為此藥物研究者研制了一系列納米制劑,包括納米粒����、膠束和脂質(zhì)體等以期增強(qiáng)藤黃酸在體內(nèi)的穩(wěn)定性和滯留時(shí)間從而增強(qiáng)其抗癌活性。此外�,紅細(xì)胞(red blood cells,RBCs)作為血液中最豐富的長(zhǎng)循環(huán)細(xì)胞�����,具有天然生物相容性����、生物可降解性和長(zhǎng)循環(huán)半衰期等特點(diǎn)����,已被廣泛用于藥物輸送系統(tǒng)。因此�,由紅細(xì)胞膜與納米材料相結(jié)合偽裝成的仿生納米顆粒逐漸成為藥物制劑的熱點(diǎn)平臺(tái)。
要點(diǎn)1:仿生納米粒的構(gòu)建及物理表征
該文章采用薄膜分散法成功制備了載藥無(wú)膜納米粒GPP-NPs���,而后通過(guò)物理擠壓法將紅細(xì)胞膜與GPP-NPs混合反復(fù)擠出制備仿生納米制劑RBC@GPP-NPs�。粒徑儀及透射電鏡檢測(cè)結(jié)果表明此兩種納米制劑為均勻分散的顆粒狀,粒徑分別為102.3±3.1 nm(圖1A和C)和89.55±0.92 nm(圖1B和D)����,RBC@GPP-NPs 直徑的增加大約等于 RBCM的厚度(圖1C和E)。此外����,RBC@GPP-NPs和GPP-NPs具有較高的包封率,分別為(79.11±1.42)%和(86.37±0.84)%�,表明仿生納米制劑可以有效地包裹藥物。
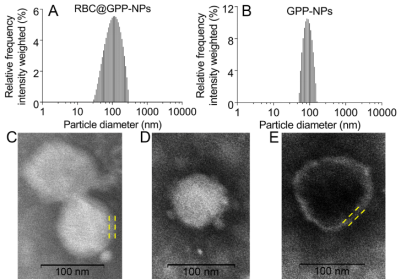
圖1. 仿生納米制劑形態(tài)大小表征
要點(diǎn)2:仿生納米粒的穩(wěn)定性��、體外釋藥行為及安全性考察
仿生納米制劑的穩(wěn)定性強(qiáng)于無(wú)膜納米�����,且其緩釋性能好�,在腫瘤生長(zhǎng)酸性環(huán)境中釋放度高于無(wú)膜納米制劑。研究結(jié)果如圖2A所示����,在第6天,RBC@GPP-NPs的平均粒徑從98.35 nm增加到100.06 nm��,增加量為1.71 nm, GPP-NPs的平均粒徑從85.01 nm增加到89.7 nm,增加量為4.69 nm���,這表明兩種制劑在6天內(nèi)都是穩(wěn)定的��,但仿生納米制劑表現(xiàn)更好�。16天后�,兩者的增量均小于7 nm。此外��,兩組PDI值在第6天后趨近于0.15����,表明兩種制劑均具有良好的分散性。在中性PBS(pH 7.4)中(圖2B)���,RBC@GPP-NPs的GA最大累積釋放率約為36.62%��,低于GPP-NPs的41.44%����。而在酸性介質(zhì)(pH 5.5)中(圖3C)�,RBC@GPP-NPs的GA最大累積釋放率增加到53.25%���,仍低于GPP-NPs的藥物累積釋放度(62.96%)�。這些結(jié)果表明,仿生納米制劑具有保持體內(nèi)有效藥物濃度的潛力���。
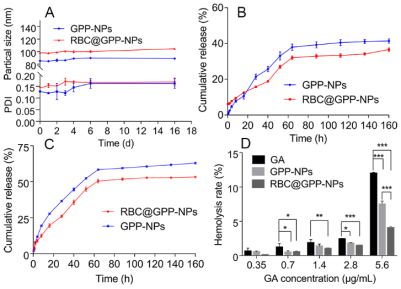
圖2. 仿生納米制劑穩(wěn)定性與釋藥過(guò)程表征
要點(diǎn)3:仿生納米粒的體外抗腫瘤活性及安全性評(píng)價(jià)
體外抗腫瘤實(shí)驗(yàn)結(jié)果顯示�����,在24小時(shí)和48小時(shí)的培養(yǎng)后���,所有藥劑都被檢測(cè)出對(duì)HepG2細(xì)胞具有劑量和時(shí)間依賴的細(xì)胞毒性。在給藥24小時(shí)后��,有利藥物和納米制劑對(duì)HepG2細(xì)胞活力的影響沒(méi)有顯著區(qū)別(圖3A)��。但當(dāng)GA濃度為0.35-1.4 μg/mL時(shí)����,RBC@GPP-NPs的細(xì)胞活力從90%迅速下降到30%(圖3B),是其他兩組的兩倍�。這可能是由于仿生納米制劑起到了緩釋控釋效果。
另外����,納米制劑和游離藥物對(duì)正常細(xì)胞的細(xì)胞毒性結(jié)果表明����,與游離藥物組相比���,納米制劑對(duì)正常細(xì)胞的毒性都有降低����,且仿生納米制劑毒性最小���。24小時(shí)后����,在低濃度下(0.35 - 2.8 μg/mL)�,仿生納米制劑對(duì)正常細(xì)胞的抑制率幾乎為零,無(wú)膜納米制劑次之(圖3C)�;48小時(shí)后,低濃度下RBC@GPP-NPs的細(xì)胞存活率明顯高于GPP-NPs和游離GA組(圖3D)��,說(shuō)明仿生納米制劑可降低藥物對(duì)正常組織的毒性�����。
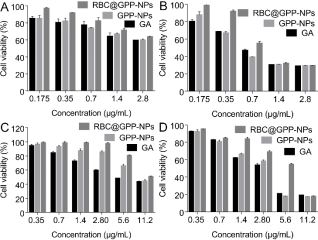
圖3. 仿生納米制劑抗體外抗腫瘤活性及安全性評(píng)價(jià)
要點(diǎn)4:仿生納米粒的體內(nèi)抗腫瘤活性評(píng)價(jià)
體內(nèi)實(shí)驗(yàn)結(jié)果表明仿生納米制劑可有效減緩腫瘤的生長(zhǎng)速度(圖4)。所有實(shí)驗(yàn)組中���,仿生納米制劑組腫瘤體積增長(zhǎng)最慢,平均體積為715 mm3�����,與生理鹽水相比具有顯著性差異(圖4C)��,其抗腫瘤作用的增強(qiáng)可能是由于仿生納米顆粒增加了小鼠體內(nèi)藥物的循環(huán)時(shí)間����。此外,H&E染色結(jié)果表明與無(wú)膜納米制劑GPP-NPs組和游離藥物組相比��,仿生納米制劑RBC@GPP-NPs表導(dǎo)致腫瘤組織中最廣泛的腫瘤組織凋亡(圖4D)��。這些結(jié)果表明RBC@GPP-NPs可抑制腫瘤細(xì)胞HepG2的生長(zhǎng)����。體內(nèi)安全性實(shí)驗(yàn)表明兩種納米制劑、游離藥物組和生理鹽水組小鼠體重?zé)o顯著差異及各組主要臟器系數(shù)均正常�,表明仿生納米制劑具有較高的安全性。
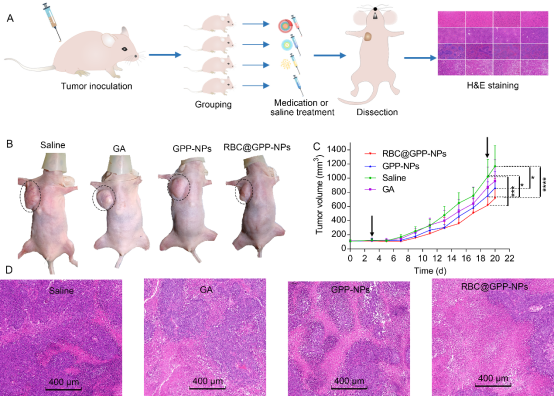
圖4. 仿生納米制劑體內(nèi)抗腫瘤評(píng)價(jià)
全文鏈接:https://doi.org/10.1016/j.cclet.2022.05.089
