Advanced Materials是國際知名期刊,其發(fā)文涵蓋了納米材料�����、生物材料�、材料物理�、材料化學����、工程材料等領域,接收相關領域的頂尖科研成果����。目前,其影響因子為32.086����。
近年來,周紹兵教授團隊一直致力于高分子納米藥物載體材料的研究���,取得了多項重要成果�����,對惡性腫瘤等重大疾病在動物實驗研究上表現(xiàn)出優(yōu)異的治療效果�。團隊已在Advanced Materials, Science Advances, Progress in Polymer Science等國際高影響期刊發(fā)表文章200余篇��,文章他引10000余次�����,獲得發(fā)明專利30項。相關研究成果正與多家企業(yè)合作�����,以推進臨床轉化�。
癌癥免疫治療正轉向如何更有效地激活免疫系統(tǒng)來消滅癌細胞。目前的免疫治療調控策略主要包括極化免疫細胞表型�,免疫檢查點封鎖,新抗原呈遞�,工程T細胞和細胞因子治療等。盡管在某些情況下����,它們在臨床前或臨床研究中有一定的效果,但腫瘤細胞的免疫逃逸和免疫抑制微環(huán)境仍會對這些策略療效產生很大限制����。考慮到腫瘤微環(huán)境(TME)是腫瘤細胞增殖和轉移的生態(tài)位���,酸性的腫瘤微環(huán)境可以阻礙抗原提呈細胞的成熟和淋巴細胞的激活�����,從而形成免疫抑制微環(huán)境�。因此����,重塑酸性TME對緩解免疫抑制具有重要意義。
對此�����,西南交通大學周紹兵教授團隊開發(fā)了一種具有多級結構的電紡纖維裝置作為局部藥物遞送系統(tǒng)���,用于重塑酸性腫瘤微環(huán)境(TME)�,以提高免疫療法的治療效果(圖1)���。纖維基質中的質子泵抑制劑(PPIs)持續(xù)釋放以抑制腫瘤細胞內H+的外排����,重塑酸性TME����。纖維內腔中的靶向膠束和M1巨噬細胞膜包被的納米顆粒可分別誘導腫瘤細胞的免疫原性細胞死亡 (ICD) 和腫瘤相關巨噬細胞 (TAM) 的表型轉化��。TME中酸度的緩解進一步促進了ICD和TAM的極化,緩解了免疫抑制微環(huán)境并協(xié)同增強了抗腫瘤免疫反應����。
體內實驗表明,PPIs從纖維基質中持續(xù)釋放���,可抑制腫瘤細胞V-ATPase活性���,將酸性TME中和至~7.2,有效緩解TME的免疫抑制��,其中Tregs和MDSCs的比例分別下降11.1%和14.2%�。DOX@M誘導原位ICD效應和R837@MPs介導的腫瘤相關巨噬細胞表型轉化,激活更有效的抗原特異性抗腫瘤免疫應答����,腫瘤殺傷免疫細胞因子(IL-6、IL-12和TNF-α)和免疫記憶細胞TCM的比例增多�����,小鼠4T1腫瘤抑制率達97%���,能夠有效抑制腫瘤轉移�。同時,將該多級結構載藥纖維裝置用于治療小鼠高轉移性腫瘤B16-F10和結腸癌CT26模型��,發(fā)現(xiàn)同樣能夠增強小鼠體內抗腫瘤免疫反應��,抑制腫瘤的生長���,延長小鼠生存率。因此��,該植入式纖維裝置在高轉移性腫瘤的治療中具有很大的應用潛力�����。
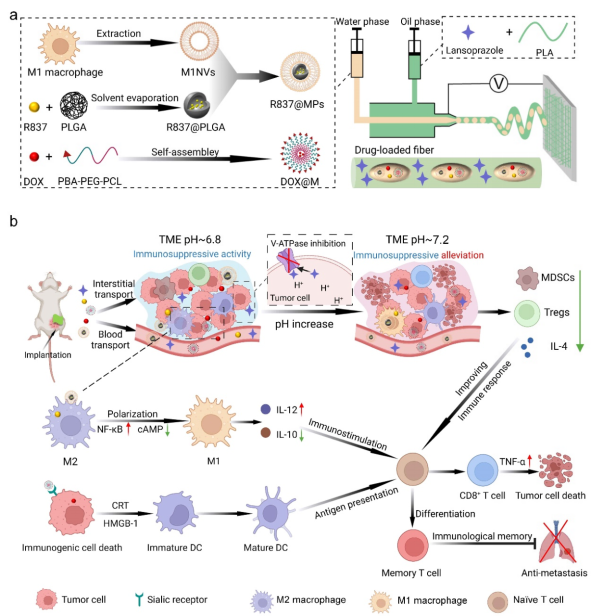
圖1.纖維裝置的制備�����、局部酸性腫瘤微環(huán)境(TME)重塑和抗腫瘤免疫激活的示意圖��。
a.裝載LPZ����、DOX@M膠束和R837@MPs的多級結構電紡纖維的制備。b.局部酸性TME重塑機制及免疫治療過程��。
以上成果發(fā)表在Advanced Materials(10.1002/adma.202300216)上。論文的第一作者為必贏bwin線路檢測中心(生物醫(yī)學工程研究院)博士研究生李艷�,必贏bwin線路檢測中心(生物醫(yī)學工程研究院)楊光副研究員和周紹兵教授為共同通訊作者。
原文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202300216
